ЕЛЕКТРОХІМІЧНИЙ ПРОЦЕС ВИДІЛЕННЯ ВОДНЮ НА НАНОСТРУКТУРОВАНІЙ ПОВЕРХНІ НІКЕЛЮ З ДОДАТКОВО ОСАДЖЕНИМ БІСМУТОМ
Сучасне матеріало- та товарознавство :: 1. Актуальні питання наукового та практичного матеріалознавства.
Сторінка 1 з 1
 ЕЛЕКТРОХІМІЧНИЙ ПРОЦЕС ВИДІЛЕННЯ ВОДНЮ НА НАНОСТРУКТУРОВАНІЙ ПОВЕРХНІ НІКЕЛЮ З ДОДАТКОВО ОСАДЖЕНИМ БІСМУТОМ
ЕЛЕКТРОХІМІЧНИЙ ПРОЦЕС ВИДІЛЕННЯ ВОДНЮ НА НАНОСТРУКТУРОВАНІЙ ПОВЕРХНІ НІКЕЛЮ З ДОДАТКОВО ОСАДЖЕНИМ БІСМУТОМ
1Шевченко О. П. к.х.н., доцент
1Лут О. А. к.х.н., доцент
2Аксіментьєва О. І. д.х.н., професор
1ЧНУ ім. Б. Хмельницького, м.Черкаси
2ЛНУ ім. Івана Франка, м.Львів
Україна, e-mail: lutlen@ukr.net
ЕЛЕКТРОХІМІЧНИЙ ПРОЦЕС ВИДІЛЕННЯ ВОДНЮ НА НАНОСТРУКТУРОВАНІЙ ПОВЕРХНІ НІКЕЛЮ З ДОДАТКОВО ОСАДЖЕНИМ БІСМУТОМ
Водень, як самий простий та легкий із всіх хімічних елементів можна вважати ідеальним паливом. Він, як енергоносій, здатний практично замінювати всі органічні види палива в різних видах транспорту, у виробництві електроенергії (паливні елементи, газові турбіни). Його запаси в формі води є практично невичерпаними. Водень екологічно безпечний, тому що продуктом його згоряння є вода. Водневе полум’я не виділяє в атмосферу продуктів, які утворюються при горінні інших видів палива: вуглекислого, чадного та сірчистого газів, а також вуглеводнів та золи. Серед важливих проблем у водневій енергетиці є розробка ефективних систем акумулювання і зберігання водню.
Одним з методів отримання водню в промисловості є електроліз води. Частка даного методу у світовому виробництві водню складає близько 5%. Основний вклад у вартість електролітичного водню (70 - 90 %) несуть затрати на електроенергію, які обумовлені перенапругою виділення водню. Стан поверхні електроду та природа металу, а також склад розчину електроліту в таких процесах відіграє особливу роль.
Проведені попередні дослідження з електрохімічного синтезу органічних сполук та виділенню водню на наноструктурованих металевих електродах типу кластер-глобула-поверхня [1,2] показали їх високу ефективність до таких процесів за рахунок низької роботи виходу електронів. Відомо [3], що електродні процеси відбуваються в межах тонкого поверхневого шару на межі електрод-йонна система, де виникає подвійний електричний шар (ПЕШ).
В даній роботі досліджено вплив йонів лужних металів на структуру ПЕШ та на перенапругу виділення водню в кислих і лужних розчинах на наноструктурованих металевих електродах нікелю з додатково осадженим Бісмутом.
На швидкість електрохімічного процесу виділення водню в значній мірі впливає ступінь гідратації йонів, а також наявність сторонніх йонів, які змінюють структуру ПЕШ та впливають на процес сольватації та змочування поверхні кластера електроду [3].
Встановлено, що додавання в розчин лугу калій хлориду веде до певного підвищення перенапруги виділення водню, і це явище відбувається тим глибше, чим менша концентрація калій гідроксиду. На рис. 1. наведені вольтамперометричні криві, одержані в розбавлених розчинах калій гідроксиду з додаванням різної кількості калій хлориду.
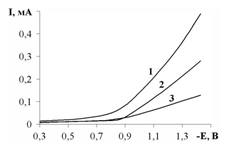
Рис. 1. Потенціодинамічні криві 0,001 моль/дм3 розчину КОН з добавками KCl (ʋ=1∙10−1В/с, Т = 293 К): 1.с(KCl) = 0,01 М; 2. с(KCl) = 0,05 М; 3. с(KCl) = 0,5 М.
З аналізу кривих видно, що інтенсивне виділення водню розпочинається в межах −0,8 –0,9 В по відношенню до потенціалу аргент-хлоридного електроду. Збільшення концентрації позитивно заряджених йонів калію веде до ущільнення подвійного електричного шару, яке створює більш міцний бар’єр для проникнення молекул води до місця їх розряду. Така закономірність характерна і для йонів Na+.
При збільшенні швидкості зміни потенціалу на один порядок струм електровідновлення (при потенціалі −1,0 В) зростає у два рази, що обумовлюється збільшенням градієнта концентрації деполяризатора біля поверхні електроду. Напруга деполяризації процесу складає 0,145 В. Так, для гладкого нікелевого електроду коефіцієнти а і b в рівнянні Тафеля в лужних розчинах відповідно дорівнюють: а = 0,65, b = 0,10. Для масивів гострійних структур нікелю з додатково осадженим Бісмутом, які мають добре розвинену поверхню коефіцієнт а рівний 0,536, b = 0,045−0,038.
Аналіз отриманих вольтамперометричних кривих показав, що при значенні рН=1 водень починає виділятися при потенціалі робочого електроду –0,1 В (рис. 2., крива 1).
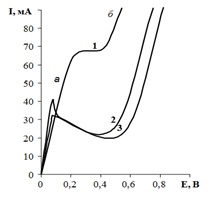
Рис. 2. Вольтамперометричні криві виділення водню з кислих розчинів на масивах гострійних структур нікелю з додатково осадженим Бісмутом (ʋ=1∙10−1В/с, Т = 293 К, pH=1):
1.розчин H2SO4 з рН=1; 2. розчин H2SO4 + с(КCl) =110-4 М; 3. розчин H2SO4+c(КCl) = 110-3 М.
На ділянці а кривої 2 водень виділяється за рахунок розряду йонів гідроксонію [3]. Перехід від нижньої ділянки до верхньої проходить через площадку граничного струму, при цьому рекомбінація для йонів гідроксонію заміняється на сповільнений розряд. При потенціалі – 0,47 В розряд буде здійснюватися як за рахунок йонів гідроксонію, так і молекул води (рис.2. ділянка б, крива 1). Введення в досліджуваний розчин калій хлориду веде до підвищення перенапруги виділення водню за обома механізмами (крива 2, 3). Така закономірність спостерігається лише для досить кислих розчинів із значенням рН рівним 1 та 2.
Відмічено, що йони літію, маючи незначний радіус, піддаються сильній сольватаці, а це веде до зменшення ступеня сольватації йонів гідроксонію, що і є вирішальним фактором, який знижує перенапругу виділення водню. При значенні рН=1 перенапруга виділення водню зростає на 0,03 В, за рахунок присутності йона Цезія.
Таким чином, проведені вольтамперометричні дослідження дали змогу проаналізувати вплив іонів металів I групи на перенапругу виділення водню, отримати вольтамперометричні криві, проаналізувати їх характер, запропонувати механізми виділення водню на різних ділянках кривих.
Список використаних інформаційних джерел:
1. Shevchenko A. P. Reduction of Chloroacetic Acid on Nanostructured Nickel Electrodes / A. P. Shevchenko, E. I. Aksimentуeva, E. A. Lut // Russian Journal of Electrochemistry, 2015. – Vol. 51, № 11.– P. 1041–1045.
2. Білий О. В. Електрохімічне дослідження процесу виділення водню з кислих розчинів на металевих електродах з масивам гострійних структур типу кластер-глобула–поверхня / О. В. Білий, Б. П. Мінаєв, О. П. Шевченко // Вопроссы химии и химической технологии. – 2004. – № 3. − С. 149−153.
3. Дамаскин Б.Б. Электрохимия. / Б.Б. Дамаскин, О.А. Петрий, Г.А. Цирлина. − М.: Химия, 2001. − С.125−129.
1Лут О. А. к.х.н., доцент
2Аксіментьєва О. І. д.х.н., професор
1ЧНУ ім. Б. Хмельницького, м.Черкаси
2ЛНУ ім. Івана Франка, м.Львів
Україна, e-mail: lutlen@ukr.net
ЕЛЕКТРОХІМІЧНИЙ ПРОЦЕС ВИДІЛЕННЯ ВОДНЮ НА НАНОСТРУКТУРОВАНІЙ ПОВЕРХНІ НІКЕЛЮ З ДОДАТКОВО ОСАДЖЕНИМ БІСМУТОМ
Водень, як самий простий та легкий із всіх хімічних елементів можна вважати ідеальним паливом. Він, як енергоносій, здатний практично замінювати всі органічні види палива в різних видах транспорту, у виробництві електроенергії (паливні елементи, газові турбіни). Його запаси в формі води є практично невичерпаними. Водень екологічно безпечний, тому що продуктом його згоряння є вода. Водневе полум’я не виділяє в атмосферу продуктів, які утворюються при горінні інших видів палива: вуглекислого, чадного та сірчистого газів, а також вуглеводнів та золи. Серед важливих проблем у водневій енергетиці є розробка ефективних систем акумулювання і зберігання водню.
Одним з методів отримання водню в промисловості є електроліз води. Частка даного методу у світовому виробництві водню складає близько 5%. Основний вклад у вартість електролітичного водню (70 - 90 %) несуть затрати на електроенергію, які обумовлені перенапругою виділення водню. Стан поверхні електроду та природа металу, а також склад розчину електроліту в таких процесах відіграє особливу роль.
Проведені попередні дослідження з електрохімічного синтезу органічних сполук та виділенню водню на наноструктурованих металевих електродах типу кластер-глобула-поверхня [1,2] показали їх високу ефективність до таких процесів за рахунок низької роботи виходу електронів. Відомо [3], що електродні процеси відбуваються в межах тонкого поверхневого шару на межі електрод-йонна система, де виникає подвійний електричний шар (ПЕШ).
В даній роботі досліджено вплив йонів лужних металів на структуру ПЕШ та на перенапругу виділення водню в кислих і лужних розчинах на наноструктурованих металевих електродах нікелю з додатково осадженим Бісмутом.
На швидкість електрохімічного процесу виділення водню в значній мірі впливає ступінь гідратації йонів, а також наявність сторонніх йонів, які змінюють структуру ПЕШ та впливають на процес сольватації та змочування поверхні кластера електроду [3].
Встановлено, що додавання в розчин лугу калій хлориду веде до певного підвищення перенапруги виділення водню, і це явище відбувається тим глибше, чим менша концентрація калій гідроксиду. На рис. 1. наведені вольтамперометричні криві, одержані в розбавлених розчинах калій гідроксиду з додаванням різної кількості калій хлориду.

Рис. 1. Потенціодинамічні криві 0,001 моль/дм3 розчину КОН з добавками KCl (ʋ=1∙10−1В/с, Т = 293 К): 1.с(KCl) = 0,01 М; 2. с(KCl) = 0,05 М; 3. с(KCl) = 0,5 М.
З аналізу кривих видно, що інтенсивне виділення водню розпочинається в межах −0,8 –0,9 В по відношенню до потенціалу аргент-хлоридного електроду. Збільшення концентрації позитивно заряджених йонів калію веде до ущільнення подвійного електричного шару, яке створює більш міцний бар’єр для проникнення молекул води до місця їх розряду. Така закономірність характерна і для йонів Na+.
При збільшенні швидкості зміни потенціалу на один порядок струм електровідновлення (при потенціалі −1,0 В) зростає у два рази, що обумовлюється збільшенням градієнта концентрації деполяризатора біля поверхні електроду. Напруга деполяризації процесу складає 0,145 В. Так, для гладкого нікелевого електроду коефіцієнти а і b в рівнянні Тафеля в лужних розчинах відповідно дорівнюють: а = 0,65, b = 0,10. Для масивів гострійних структур нікелю з додатково осадженим Бісмутом, які мають добре розвинену поверхню коефіцієнт а рівний 0,536, b = 0,045−0,038.
Аналіз отриманих вольтамперометричних кривих показав, що при значенні рН=1 водень починає виділятися при потенціалі робочого електроду –0,1 В (рис. 2., крива 1).

Рис. 2. Вольтамперометричні криві виділення водню з кислих розчинів на масивах гострійних структур нікелю з додатково осадженим Бісмутом (ʋ=1∙10−1В/с, Т = 293 К, pH=1):
1.розчин H2SO4 з рН=1; 2. розчин H2SO4 + с(КCl) =110-4 М; 3. розчин H2SO4+c(КCl) = 110-3 М.
На ділянці а кривої 2 водень виділяється за рахунок розряду йонів гідроксонію [3]. Перехід від нижньої ділянки до верхньої проходить через площадку граничного струму, при цьому рекомбінація для йонів гідроксонію заміняється на сповільнений розряд. При потенціалі – 0,47 В розряд буде здійснюватися як за рахунок йонів гідроксонію, так і молекул води (рис.2. ділянка б, крива 1). Введення в досліджуваний розчин калій хлориду веде до підвищення перенапруги виділення водню за обома механізмами (крива 2, 3). Така закономірність спостерігається лише для досить кислих розчинів із значенням рН рівним 1 та 2.
Відмічено, що йони літію, маючи незначний радіус, піддаються сильній сольватаці, а це веде до зменшення ступеня сольватації йонів гідроксонію, що і є вирішальним фактором, який знижує перенапругу виділення водню. При значенні рН=1 перенапруга виділення водню зростає на 0,03 В, за рахунок присутності йона Цезія.
Таким чином, проведені вольтамперометричні дослідження дали змогу проаналізувати вплив іонів металів I групи на перенапругу виділення водню, отримати вольтамперометричні криві, проаналізувати їх характер, запропонувати механізми виділення водню на різних ділянках кривих.
Список використаних інформаційних джерел:
1. Shevchenko A. P. Reduction of Chloroacetic Acid on Nanostructured Nickel Electrodes / A. P. Shevchenko, E. I. Aksimentуeva, E. A. Lut // Russian Journal of Electrochemistry, 2015. – Vol. 51, № 11.– P. 1041–1045.
2. Білий О. В. Електрохімічне дослідження процесу виділення водню з кислих розчинів на металевих електродах з масивам гострійних структур типу кластер-глобула–поверхня / О. В. Білий, Б. П. Мінаєв, О. П. Шевченко // Вопроссы химии и химической технологии. – 2004. – № 3. − С. 149−153.
3. Дамаскин Б.Б. Электрохимия. / Б.Б. Дамаскин, О.А. Петрий, Г.А. Цирлина. − М.: Химия, 2001. − С.125−129.
Сучасне матеріало- та товарознавство :: 1. Актуальні питання наукового та практичного матеріалознавства.
Сторінка 1 з 1
Права доступу до цього форуму
Ви не можете відповідати на теми у цьому форумі